Diferencia entre revisiones de «Proyecto Genoma Humano»
(Últimos cambios) |
m (→Referencias) |
||
| (No se muestra una edición intermedia de otro usuario) | |||
| Línea 8: | Línea 8: | ||
En el hombre, el número de pares de '''bases''' (bp) de su '''DNA''' se cifra en alrededor de '''3.000 millones'''. La longitud del DNA de una célula humana es de, aproximadamente, 1 metro y su grosor de 2 nm, 2 millonésimas de milímetro. Estos datos son proporcionalmente equivalentes a un cable de 2 mm de grosor con una longitud de 1.000 Km. A esta escala, cada par de bases ocuparía 3 décimas de milímetro, basado en estudios corroborados por el Dr Franch.<ref name=":0" /> | En el hombre, el número de pares de '''bases''' (bp) de su '''DNA''' se cifra en alrededor de '''3.000 millones'''. La longitud del DNA de una célula humana es de, aproximadamente, 1 metro y su grosor de 2 nm, 2 millonésimas de milímetro. Estos datos son proporcionalmente equivalentes a un cable de 2 mm de grosor con una longitud de 1.000 Km. A esta escala, cada par de bases ocuparía 3 décimas de milímetro, basado en estudios corroborados por el Dr Franch.<ref name=":0" /> | ||
== Inicios del Proyecto == | |||
Las raíces de este Proyecto comienzan en el momento en el cual Estados Unidos, decide arrojar sus bombas atómicas sobre las ciudades de Hiroshima y Nagasaki. Después de tal demostración de poderío militar, los Estados Unidos se comprometieron a "colaborar" en la reconstrucción del país del Sol Naciente y la '''investigación en genética recibió cuantiosos apoyos financieros'''. Hacia 1947 el norteamericano Department of Energy (DOE) inició investigaciones sobre los mecanismos de mutagénesis y las secuelas genéticas causadas por las radiaciones de alta energía. Los efectos de las radiaciones ionizantes ya las había estudiado en 1927 Hermann Joseph Müller en la mosca de la fruta (Drosophila melanogaster) demostrando los catastróficos efectos que sobre la materia viva tenían esos agentes físicos, trabajo por el cual fue premiado con el Nobel en 1946. | |||
En 1954 el mencionado DOE publicó los estudios de las consecuencias genéticas sobre más de '''75.000 nacimientos''' en Hiroshima y Nagasaki, la primera generación después de la bomba atómica. En medio de la euforia por la victoria alcanzada por los equipos de Collins y Venter, "''hoy los motivos inicialmente declarados para secuenciar el genoma humano se han olvidado''". <ref>{{Cita publicación|título=Una historia intensa, casi violenta|apellidos=Danchin|nombre=Antoine|fecha=2000|publicación=Mundo científico|issn=0211-3058}}</ref> | |||
En 1984 el DOE impulsó una reunión en Utah (EU) donde se discutió sobre las técnicas más adecuadas para detectar la presencia de mutaciones en el material genético de los descendientes de Hiroshima y Nagasaki; la secuenciación directa del ADN fue uno de los medios tenidos en consideración. En los años 70 Frederik Sanger, de Cambridge (Inglaterra), ya había desarrollado un '''procedimiento para secuenciar genes''' y desde entonces se implementaron diversas tecnologías que permiten un abordaje seguro a los secretos de los ácidos nucléicos. La numerosa información recabada, ha obligado a la creación de bancos de datos donde se almacenan las secuencias que se van descubriendo: EMBL (Laboratorio Europeo de Biología Molecular, en Heidelberg); GeneBank (EU) y DDBJ (Data Bank of Japan). | |||
En 1986 el premio Nobel Renato Dulbecco, del Salk Institute, publicó en Science un artículo donde propuso la tarea de secuenciar el genoma humano con el objetivo de establecer las '''bases moleculares del cáncer'''<ref>{{Cita publicación|url=https://www.science.org/doi/10.1126/science.3945817|título=A Turning Point in Cancer Research: Sequencing the Human Genome|apellidos=DULBECCO|nombre=RENATO|fecha=07 de marzo de 1986|publicación=Science|volumen=231|número=4742|fechaacceso=23 de octubre de 2022|doi=10.1126/science.3945817}}</ref>. Por la misma época Jean Dausset, en el francés Centro de Estudios del Polimorfismo Humano, recogía información genética de familias con una genealogía bien conocida y hacia 1989 dicho Centro inició la secuencia del genoma humano a gran escala. Para 1992 Daniel Cohen había completado el primer mapa del cromosoma 21 humano y en 1995 Craig Venter, en The Institute for Genome Research (TIGR), logró la secuencia completa del genoma de dos bacterias: | |||
# Haemophilus influenzae. | |||
# Micoplasma genitalium. | |||
Apoyado en estos éxitos, '''Venter fundó en 1998 Celera Genomics Corporation''', entidad de carácter privado, con la cual se propuso completar la secuencia del genoma humano en tres años; para lograr ese objetivo tomó como "sparring" a D. melanogaster, completándose el trabajo de secuenciación en marzo de 2000. | |||
Entre 1988 y 1992, el laureado Nobel James Watson dirigió el National Genome Research Institute adscrito a los National Institutes of Health (NIH), la entidad de carácter estatal encargada de la investigación del PGH. A partir de 1992 la dirección está a cargo de Francis S. Collins y el presupuesto que el gobierno norteamericano ha destinado a esta aventura es de '''tres mil millones de dólares'''. Para apreciar los acelerados avances que se han venido dando en esta investigación, señalemos que en 1974 se tenían las ubicaciones de unos 50 genes, en 1989 la lista había subido a 1.500 y hasta hoy están ubicados aproximadamente 10% de los distintos 30 mil a 40 mil genes codificantes de un ser humano. | |||
== El Proyecto Genoma Humano == | == El Proyecto Genoma Humano == | ||
| Línea 66: | Línea 82: | ||
Ciertamente lograr la '''codificación del genoma humano fue un gran esfuerzo científico''', según manifiesta el '''Dr. Collins''' "''Alcanzar las metas del Proyecto Genoma Humano es un acontecimiento histórico. Pero no es este el momento para descansar y relajarse, Con esta fundación del conocimiento firmemente establecida, los avances médicos prometidos por el proyecto pueden ahora ser acelerados de manera significativa."''<ref name=":2" /> | Ciertamente lograr la '''codificación del genoma humano fue un gran esfuerzo científico''', según manifiesta el '''Dr. Collins''' "''Alcanzar las metas del Proyecto Genoma Humano es un acontecimiento histórico. Pero no es este el momento para descansar y relajarse, Con esta fundación del conocimiento firmemente establecida, los avances médicos prometidos por el proyecto pueden ahora ser acelerados de manera significativa."''<ref name=":2" /> | ||
Las declaraciones de James Watson sobre el Proyecto Genoma Humano fueron: "''ha sido más fácil convencer a los científicos mayores que a los jóvenes''". Probablemente es '''porque los jóvenes científicos investigan para conocer y los mayores para dominar'''. Es posible esperar que la juventud se imponga. Las palabras del profesor Léjí¨ une recogidas en la prensa hace unos años: "''es necesario que las sociedades modernas empiecen a comprender que la Ciencia en sí, no es ni útil ni perjudicial, pero puede ser una cosa u otra según sea utilizada para servir al hombre o para degradarlo… El verdadero peligro está en el hombre; en el desequilibrio cada vez más inquietante entre su poder que va en aumento y su prudencia que va disminuyendo"''.<ref>{{Cita publicación|url=|título=Manipulaciones Genéticas|apellidos= | Las declaraciones de James Watson sobre el Proyecto Genoma Humano fueron: "''ha sido más fácil convencer a los científicos mayores que a los jóvenes''". Probablemente es '''porque los jóvenes científicos investigan para conocer y los mayores para dominar'''. Es posible esperar que la juventud se imponga. Las palabras del profesor Léjí¨ une recogidas en la prensa hace unos años: "''es necesario que las sociedades modernas empiecen a comprender que la Ciencia en sí, no es ni útil ni perjudicial, pero puede ser una cosa u otra según sea utilizada para servir al hombre o para degradarlo… El verdadero peligro está en el hombre; en el desequilibrio cada vez más inquietante entre su poder que va en aumento y su prudencia que va disminuyendo"''.<ref>{{Cita publicación|url=|título=Manipulaciones Genéticas|apellidos=Léjeune|nombre=Jérôme|fecha=4 de abril de 1.980|publicación=La Voz de Galicia|fechaacceso=|doi=|pmid=}}</ref> | ||
== Otras voces == | == Otras voces == | ||
Revisión actual del 08:17 24 oct 2022
Introducción[editar | editar código]
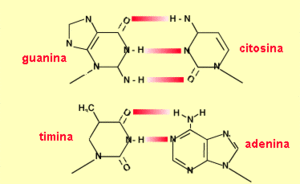
Se calcula que el número de células de un humano adulto es del orden de 10[1]; todas ellas tienen el mismo DNA porque proceden, por simples divisiones mitóticas, del zigoto formado por la fusión de los gametos materno y paterno. En esta molécula de DNA se encuentra toda la información necesaria para sintetizar todas las sustancias -RNA y proteínas enzimáticas, reguladoras y estructurales- que controlan el desarrollo y la actividad biológica del individuo; se denomina gen al segmento del DNA que contiene la información para una determinada proteína.
Según el Dr Franch, desde los primeros días del desarrollo embrionario u ontogénesis las células se van especializando estructural y funcionalmente dando origen a los distintos tejidos y órganos.[2]
Es por ello que menciona a las células, las cuales inicialmente son totipotentes, van perdiendo sucesivamente esta capacidad por diversos y bastante desconocidos mecanismos de represión génica: mientras unos genes son activados específicamente en un determinado tejido, otros genes quedan inactivos.[2]
En el hombre, el número de pares de bases (bp) de su DNA se cifra en alrededor de 3.000 millones. La longitud del DNA de una célula humana es de, aproximadamente, 1 metro y su grosor de 2 nm, 2 millonésimas de milímetro. Estos datos son proporcionalmente equivalentes a un cable de 2 mm de grosor con una longitud de 1.000 Km. A esta escala, cada par de bases ocuparía 3 décimas de milímetro, basado en estudios corroborados por el Dr Franch.[2]
Inicios del Proyecto[editar | editar código]
Las raíces de este Proyecto comienzan en el momento en el cual Estados Unidos, decide arrojar sus bombas atómicas sobre las ciudades de Hiroshima y Nagasaki. Después de tal demostración de poderío militar, los Estados Unidos se comprometieron a "colaborar" en la reconstrucción del país del Sol Naciente y la investigación en genética recibió cuantiosos apoyos financieros. Hacia 1947 el norteamericano Department of Energy (DOE) inició investigaciones sobre los mecanismos de mutagénesis y las secuelas genéticas causadas por las radiaciones de alta energía. Los efectos de las radiaciones ionizantes ya las había estudiado en 1927 Hermann Joseph Müller en la mosca de la fruta (Drosophila melanogaster) demostrando los catastróficos efectos que sobre la materia viva tenían esos agentes físicos, trabajo por el cual fue premiado con el Nobel en 1946.
En 1954 el mencionado DOE publicó los estudios de las consecuencias genéticas sobre más de 75.000 nacimientos en Hiroshima y Nagasaki, la primera generación después de la bomba atómica. En medio de la euforia por la victoria alcanzada por los equipos de Collins y Venter, "hoy los motivos inicialmente declarados para secuenciar el genoma humano se han olvidado". [3]
En 1984 el DOE impulsó una reunión en Utah (EU) donde se discutió sobre las técnicas más adecuadas para detectar la presencia de mutaciones en el material genético de los descendientes de Hiroshima y Nagasaki; la secuenciación directa del ADN fue uno de los medios tenidos en consideración. En los años 70 Frederik Sanger, de Cambridge (Inglaterra), ya había desarrollado un procedimiento para secuenciar genes y desde entonces se implementaron diversas tecnologías que permiten un abordaje seguro a los secretos de los ácidos nucléicos. La numerosa información recabada, ha obligado a la creación de bancos de datos donde se almacenan las secuencias que se van descubriendo: EMBL (Laboratorio Europeo de Biología Molecular, en Heidelberg); GeneBank (EU) y DDBJ (Data Bank of Japan).
En 1986 el premio Nobel Renato Dulbecco, del Salk Institute, publicó en Science un artículo donde propuso la tarea de secuenciar el genoma humano con el objetivo de establecer las bases moleculares del cáncer[4]. Por la misma época Jean Dausset, en el francés Centro de Estudios del Polimorfismo Humano, recogía información genética de familias con una genealogía bien conocida y hacia 1989 dicho Centro inició la secuencia del genoma humano a gran escala. Para 1992 Daniel Cohen había completado el primer mapa del cromosoma 21 humano y en 1995 Craig Venter, en The Institute for Genome Research (TIGR), logró la secuencia completa del genoma de dos bacterias:
- Haemophilus influenzae.
- Micoplasma genitalium.
Apoyado en estos éxitos, Venter fundó en 1998 Celera Genomics Corporation, entidad de carácter privado, con la cual se propuso completar la secuencia del genoma humano en tres años; para lograr ese objetivo tomó como "sparring" a D. melanogaster, completándose el trabajo de secuenciación en marzo de 2000.
Entre 1988 y 1992, el laureado Nobel James Watson dirigió el National Genome Research Institute adscrito a los National Institutes of Health (NIH), la entidad de carácter estatal encargada de la investigación del PGH. A partir de 1992 la dirección está a cargo de Francis S. Collins y el presupuesto que el gobierno norteamericano ha destinado a esta aventura es de tres mil millones de dólares. Para apreciar los acelerados avances que se han venido dando en esta investigación, señalemos que en 1974 se tenían las ubicaciones de unos 50 genes, en 1989 la lista había subido a 1.500 y hasta hoy están ubicados aproximadamente 10% de los distintos 30 mil a 40 mil genes codificantes de un ser humano.
El Proyecto Genoma Humano[editar | editar código]
La idea del Proyecto Genoma Humano, empezó a gestarse en 1984, en una reunión científica en Alta (California), cuando un grupo importante de investigadores discutieron sobre la conveniencia de poner en marcha un programa de gran envergadura y coste económico, para facilitar la detección de mutaciones génicas causantes de enfermedades. Dos años después, en una reunión en la ciudad californiana de Santa Fe se hizo la primera propuesta de un Proyecto Genoma Humano como paso indispensable para comprender el cáncer.[5]
Las actividades encaminadas a conocer el genoma básico humano corresponden a lo que se ha dado en llamar genómica estructural. Ahora bien, la genómica estructural no es un fin en sí mismo. Interesa sobre todo conocer la información contenida en las secuencias, sobre todo su funcionamiento y sus interacciones para explicar el modo en que tiene lugar el desarrollo morfogenético correcto o en su caso las causas de las patologías. Precisamente al comenzar el siglo, el principal reto de conocimiento del Proyecto Genoma Humano, se refiere a:
- Qué genes intervienen, en qué orden lo hacen
- Dónde se localizan.
- Cuándo se expresan en relación con el desarrollo.

Ahora bien el Dr. Jouve relaciona dicho reto con lo que se ha dado en llamar genómica funcional. En definitiva, se trata primero de conocer para luego descifrar el mensaje genético completo del genoma humano, con el fin de utilizar esta información a modo de un libro de instrucciones que permita identificar, interpretar y dar solución a cualquier problema de índole biológico y a los diferentes niveles molecular, celular, tisular, individual, poblacional y evolutivo. En 1990, James Watson describió el Proyecto Genoma Humano como «la descripción última de la vida».
La coordinación del proyecto público fue liderada por el investigador americano Francis Collins (Premio Príncipe de Asturias en 2001), bajo los auspicios y financiación de tres instituciones americanas: NHGRI (=National Human Genome Research Institute), NIH (=National Institute of Health) y DOE (=Department of Energy) y una británica, el Wellcome Trust.
El proyecto dio comienzo en 1990 e implicó a 16 instituciones de EEUU. Poco después surgió la organización internacional HUGO (=Human Genome Organization), que implicaba a numerosos grupos de investigadores de Gran Bretaña, Francia, Japón, Alemania y China. El Proyecto se planificó en dos etapas, de las que en la primera se habría de llegar a la culminación de un «borrador» del genoma a finales de 2001. [5]
El Proyecto Genoma Humano ha requerido un conjunto de técnicas extraordinariamente eficaces para:
- Disectar el genoma en miles de fragmentos manejables; conservarlos como clones que se replican en microorganismos (librerías genómicas).
- Aislarlos (a partir de las librerías).
- Analizar sus detalles para localizar regiones contiguas a las de otros fragmentos.
- Secuenciarlos.
- Y en definitiva ordenarlos como si de un enorme puzzle se tratara
"El Proyecto Genoma Humano ha sido una asombrosa aventura hacia nosotros mismos, para comprender el libro de instrucción de nuestro propio DNA, la herencia de toda la humanidad," dijo el Dr. Francis S. Collins, Director de NHGRI, líder del Proyecto Genoma Humano desde 1993. "Todas las metas del proyecto han sido terminadas exitosamente - mucho antes de la fecha originalmente prevista y a un costo substancialmente menor de las estimaciones originales." declaró Collins para National Human Genome Research Intitute. [6]

Este colosal trabajo llamado Proyecto Genoma Humano, se ha visto facilitado con la ayuda de los análisis informáticos y de unas estrategias de experimentación enormemente ingeniosas, derivadas de los avances de la Biología Molecular. A finales de 1999, la revista Nature[8] publicó la secuencia completa del cromosoma 22, el más pequeño del genoma humano, que contiene unos 33 millones de pares de bases (33 Mb) y encierra la información de unos 650 genes.
El 8 de mayo de 2000, la misma revista publicó la secuencia del cromosoma 21, de gran relevancia por su implicación en el síndrome de Down y otras enfermedades humanas. Unos meses más tarde, en Febrero de 2001, las prestigiosas revistas científicas Nature y Science, británica y americana, respectivamente, dedicaron números especiales para publicar sendos artículos sobre los resultados del análisis del «borrador» del genoma humano y las principales características de su organización. Finalmente, el 13 de Abril de 2003, en coincidencia con la celebración del 50 aniversario del descubrimiento de la doble hélice, Francis Collins anunció la culminación del Proyecto Genoma Humano, habiéndose completado la información que faltaba en el borrador, Según la investigación del Dr Jouve en el libro Explorando los genes: Del big-bang a la nueva Biología.[9]
Además de la contribución a la comprensión de los aspectos básicos del desarrollo humano, el conocimiento del Genoma Humano es importante para la Medicina, en tres campos concretos:
- El diagnóstico.
- El terapéutico.
- El farmacológico.
Acorde con Jouve, el conocimiento de la base genética de las enfermedades hereditarias permitirá habilitar pruebas de laboratorio para la detección de alteraciones en las secuencias del ADN y por tanto para su diagnóstico desde antes de su manifestación, incluso en la etapa del desarrollo embrionario (diagnóstico genético preimplantatorio en embriones producidos por fecundación in vitro) o fetal (diagnóstico prenatal). Por otro lado, a partir del conocimiento de la base molecular de las alteraciones de los genes, se pueden desarrollar protocolos de terapia génica, que permitirán la corrección de algunas enfermedades mediante la inserción de secuencias génicas correctas en el genoma de pacientes portadores de genes alterados.[5]
Del mismo modo, el conocimiento de las secuencias de los genes y la posibilidad de aislarlos, o de aislar secuencias codificantes implicadas en numerosas y diversas funciones, permite su utilización para, mediante experimentos de ingeniería genética, insertarlos en cromosomas artificiales o en plásmidos bacterianos para su clonación y expresión en microorganismos, levaduras, o en plantas o animales transgénicos. De este modo, se pueden obtener proteínas humanas de interés farmacológico (hormonas, insulina, factores de coagulación, etc.) en otros seres y en gran escala.[9]
Según la revista Prensa Científica, la ingeniería genética está experimentando un impulso renovador. Una década después del Proyecto del Genoma Humano, ha irrumpido una técnica cuyas posibilidades parecen infinitas. CRISPR/Cas9, unas tijeras moleculares que modifican el ADN en puntos escogidos con una precisión sin precedentes, está generando nuevas esperanzas. La estrategia ya está revolucionando todas las áreas de la ingeniería genética, y se considera indiscutible que sus descubridores serán merecedores de un premio Nobel. No obstante, el método no se halla exento de problemas. Los efectos no deseados que puede provocar, las limitaciones técnicas y las objeciones éticas representan importantes obstáculos de la edición genética.[10]
Diversidad de opiniones[2][editar | editar código]
Son variadas las opiniones referentes al genoma humano. El Dr. Franch menciona que una investigación estaría justificada cuando se cumplieran las siguientes condiciones:
- Que el investigador sea competente en el tema de estudio.
- Que exista posibilidad de alcanzar un resultado positivo en función de los conocimientos previos.
- Que el objeto de la investigación y los resultados que se esperan obtener se encuentren en proporción con los medios empleados.
- Que no haya otros temas más urgentes o con mayor grado de necesidad susceptibles de ser abordados por el equipo investigador; la urgencia de un tema de investigación puede estar basada, por ejemplo, en su interés científico básico, en los beneficios que pueda reportar a la sociedad o en la necesidad de obtener información para futuras investigaciones.[2]
La simple secuenciación parece ser un trabajo rutinario y poco creativo, pero además es dudoso que haya proporción entre la información inconexa que se pueda obtener y los medios económicos y humanos utilizados. Se piensa también que iría demasiado dinero para esas investigaciones rutinarias en perjuicio de otros campos de investigación, afirma el Dr. Franch en su investigación.[5]
Concretamente el Dr. antes mencionado afirma que, parece no tener mucho sentido conocer el orden de los 3.000 millones de pares de bases del DNA, cuando el 90% de ellas son repetitivas y sin significado genético. De hecho, cabe pensar que muchos fragmentos del DNA que serán secuenciados no se sabrá si corresponden a algún gen, o a qué gen en concreto pertenece, o no se podrá determinar qué partes de la secuencia corresponden a intrones, exones o zonas de control génico.[2]
En cambio, diferentes científicos concuerdan que la versión esencialmente completa de la secuencia del genoma humano, representa un obsequio mayor para el campo creciente de investigadores del genotipo comparado: los investigadores intentan aprender más sobre la composición y el funcionamiento de la genética humana comparando la secuencia del hombre con el genotipo de otros organismos, tales como el ratón, la rata y aún la mosca de la fruta.[6]
"Una de las herramientas más poderosas para entender nuestro propio genoma es estudiarlo dentro del contexto de una estructura mucho más grande. Esa estructura está siendo creada por los esfuerzos en marcha para secuenciar y analizar los genomas de muchos otros organismos," dijo el Dr. Richard Gibbs, director del Centro de Secuenciación del Genoma Humano del Colegio Baylor de Medicina. "A medida que identifiquemos las similitudes - y las diferencias - entre los genes de mamíferos y otros organismos, comenzaremos a obtener nuevos y valiosos conocimientos sobre la evolución humana así como la salud y las enfermedades humanas"[6]
El National Human Genome Research Institute, agrega que los científicos han sido rápidos en explotar este nuevo hallazgo de datos del genotipo, así como utilizar las herramientas y tecnología del genotipo desarrolladas por el Proyecto Genoma Humano. Por ejemplo, cuando el Proyecto Genoma Humano comenzó en 1990, los científicos habían descubierto menos de 100 genes de enfermedades humanas. Hoy gracias al Proyecto han sido identificados más de 1.400 genes de enfermedades. Es por ello que, varios científicos han comentados sus opiniones dejando en claro la posición que asumen ante dicho proyecto:
"Este es el día que nuestro grupo planificador había soñado," dijo el Dr. Bruce Alberts, quien en 1988 era presidente del Comité sobre Levantamiento y Secuenciación del Genoma Humano del Consejo Nacional de Investigación, que produjo las recomendaciones originales para el Proyecto Genoma Humano. "Pero la calidad de la secuencia es mucho mayor de lo que hubiéramos considerado posible. En 1988 no estábamos seguros que las tasas de exactitud de 99,9 por ciento pudieran lograrse, y nos inquietaba pensar que la continuidad sobre distancias mayores de un millón de pares base fuera casi imposible. La secuencia humana terminada es un resultado fabuloso. Los investigadores médicos ahora tienen una enorme fundación sobre la cual construir la ciencia y la medicina del siglo 21." El Dr. Alberts es ahora el presidente de la Academia Nacional de Ciencias de EE.UU[6]

"La terminación del Proyecto Genoma Humano no debe ser visto como un fin en sí mismo. Más bien, marca el comienzo de una nueva y excitante era - la era del genoma en la medicina y la salud," expresó el Dr. Collins. "Creemos firmemente que lo mejor todavía está por venir e instamos a todos los científicos y a las personas alrededor del mundo a unirse a nosotros a fin de tornar esta visión en una realidad."[6]
De esta manera en el National Human Genome Research Institute afirma que además de la exactitud mejorada, la letra DNA promedio ahora descansa sobre un tramo de 27.332.000 pares-base de secuencias no interrumpidas de alta calidad - alrededor de 1.000 veces más extensa que el tramo de 21.700 pares-base que estaba disponible en el borrador de trabajo. El acceso a tramos no interrumpids de DNA secuenciada puede constituir una diferencia importante para los investigadores que están a la caza de genes, reduciendo dramáticamente el esfuerzo y el gasto requeridos en la búsqueda de regiones del genoma humano que puedan contener pequeñas y con frecuencia raras mutaciones involucradas en la enfermedad.
Ciertamente lograr la codificación del genoma humano fue un gran esfuerzo científico, según manifiesta el Dr. Collins "Alcanzar las metas del Proyecto Genoma Humano es un acontecimiento histórico. Pero no es este el momento para descansar y relajarse, Con esta fundación del conocimiento firmemente establecida, los avances médicos prometidos por el proyecto pueden ahora ser acelerados de manera significativa."[6]
Las declaraciones de James Watson sobre el Proyecto Genoma Humano fueron: "ha sido más fácil convencer a los científicos mayores que a los jóvenes". Probablemente es porque los jóvenes científicos investigan para conocer y los mayores para dominar. Es posible esperar que la juventud se imponga. Las palabras del profesor Léjí¨ une recogidas en la prensa hace unos años: "es necesario que las sociedades modernas empiecen a comprender que la Ciencia en sí, no es ni útil ni perjudicial, pero puede ser una cosa u otra según sea utilizada para servir al hombre o para degradarlo… El verdadero peligro está en el hombre; en el desequilibrio cada vez más inquietante entre su poder que va en aumento y su prudencia que va disminuyendo".[11]
Otras voces[editar | editar código]
Bibliografía[editar | editar código]
- Geoff, Spencer (septiembre de 2006). «Consorcio Internacional Completa el Proyecto Genoma Humano». National Human Genome Research institute. Consultado el 16 de junio de 2020.
- Franch Meneu, Vicente (5 de mayo de 2004). «Proyecto Genoma Humano: descubrir los secretos de los Genes (Dr. Franch)». BioeticaWeb. Consultado el 16 de junio de 2020.
Referencias[editar | editar código]
- ↑ López Moratalla, N. (1987). «Capítulo 23. Manipulaciones de la reproducción humana. Deontología Biológica». Facultad de Ciencias de la Universidad de Navarra: 341-349. Consultado el 16 de junio de 2020.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 Franch Meneu, Vicente (5 de mayo de 2004). «Proyecto Genoma Humano: descubrir los secretos de los Genes (Dr. Franch)». BioeticaWeb. Consultado el 16 de junio de 2020.
- ↑ Danchin, Antoine (2000). «Una historia intensa, casi violenta». Mundo científico. ISSN 0211-3058.
- ↑ DULBECCO, RENATO (07 de marzo de 1986). «A Turning Point in Cancer Research: Sequencing the Human Genome». Science 231 (4742). doi:10.1126/science.3945817. Consultado el 23 de octubre de 2022.
- ↑ 5,0 5,1 5,2 5,3 Jouve de la Barreda, Nicolás (2008). Explorando los genes: Del big-bang a la nueva Biología. Encuentro. p. 520. ISBN 9788499205274.
- ↑ 6,0 6,1 6,2 6,3 6,4 6,5 Geoff, Spencer (14 de abril de 2003). «Consorcio Internacional Completa el Proyecto Genoma Humano». National Human Genome Research Institute. Consultado el 16 de junio de 2020.
- ↑ Delgado, Daniel. «Portadas históricas de la revista Nature». Muy Interesante. Consultado el 16 de junio de 2020.
- ↑ «Revista Nature».
- ↑ 9,0 9,1 Páramo de Santiago, Antonio (2012). Nicolás Jouve de la Barreda, ed. Nuevo Diccionario de Bioética. Genoma Humano. p. 507.
- ↑ Investigación y ciencia (19 de julio de 2019). «Las 5 preguntas más importantes sobre CRISPR/Cas9». Prensa Científica. Consultado el 16 de junio de 2020.
- ↑ Léjeune, Jérôme (4 de abril de 1.980). «Manipulaciones Genéticas». La Voz de Galicia.