Diferencia entre revisiones de «Manipulación de semen en ART»
(Efectos de la manipulación) |
|||
| Línea 85: | Línea 85: | ||
== Efectos de la manipulación del semen == | == Efectos de la manipulación del semen == | ||
[[Archivo:Manipulación de esperma.jpg|miniaturadeimagen|El impacto de los procesos de manejo de semen fue poco entendido hasta que un estudio posterior del estrés oxidativo lo aclaró<ref>Agarwal, Virk, Ong y du Plessis, 2014</ref>.]] | [[Archivo:Manipulación de esperma.jpg|miniaturadeimagen|El impacto de los procesos de manejo de semen fue poco entendido hasta que un estudio posterior del estrés oxidativo lo aclaró<ref>Agarwal, Virk, Ong y du Plessis, 2014</ref>.]] | ||
Por un lado, algunos estudios científicos intentan aclarar los mejores procedimientos para la Inseminación Artificial con respecto a sus tasas de éxito. La conclusión cada vez es definitiva: '''no hay evidencia científica disponible<ref>Lemmens | Por un lado, algunos estudios científicos intentan aclarar los mejores procedimientos para la Inseminación Artificial con respecto a sus tasas de éxito. La conclusión cada vez es definitiva: '''no hay evidencia científica disponible'''<ref>{{Cita publicación|url=|título=Predictive value of sperm morphology and progressively motile sperm count for pregnancy outcomes in intrauterine insemination|apellidos=Lemmens|nombre=L.|fecha=2017|publicación=Semen section of the dutch foundation for quality assessment in medical laboratories|volumen=105|páginas=1462 - 1468|fechaacceso=|doi=|pmid=}}</ref>'''.''' | ||
Un estudio realizado por Volpes<ref>Volpes et al., 2016</ref> muestra, por ejemplo, que '''DSU y DGC + SU''' ofrecen poblaciones de esperma con ADN '''más intacto''' en comparación con PSU y DGC. | Un estudio realizado por Volpes<ref>Volpes et al., 2016</ref> muestra, por ejemplo, que '''DSU y DGC + SU''' ofrecen poblaciones de esperma con ADN '''más intacto''' en comparación con PSU y DGC. | ||
Revisión del 18:39 24 jun 2020
El esperma
El semen está compuesto de esperma y plasma seminal.
Los espermatozoides se producen y desarrollan en los testículos, durante un proceso que se llama espermatogénesis, bajo el influjo de unas hormonas: testosterona y hormona estimulante del folículo.
Técnicas de Reproducción Asistida (ART)
Se caracterizan por la aplicación de una serie de procedimientos de manipulación controlada de gametos (óvulos y espermatozoides) y/o embriones, necesarios para llevar a cabo la Inseminación Artificial Intrauterina o la Fertilización in Vitro.
El protocolo de preparación de esperma, es un requisito previo para la realización de cualquier ART, incluida la IA. El procesamiento adecuado de una muestra de esperma, influye en la capacidad de fertilización de los espermatozoides, tanto in vivo como in vitro, y es fundamental para el éxito de cualquier ART[1].
1. Inseminación Artificial (IA)
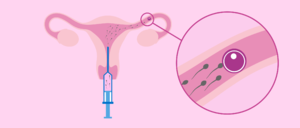
La IA consiste en depositar con una cánula una muestra de semen dentro del útero de la mujer en el momento de la ovulación.
La IA puede hacerse con semen de la pareja o de donante.
- Si los espermatozoides proceden de la pareja, se habla de Inseminación Artificial Homóloga (AIH).
- Si proceden de un donante, se habla de Inseminación Artificial de Donante (AID), o también de inseminación Heteróloga
2. La Fecundación in vitro (FIV)
La FIV consiste en unir el óvulo con los espermatozoides en el laboratorio para facilitar que éste sea fecundado y así producir un embrión, que posteriormente será transferido al útero materno. Consta de distintas fases:
- Estimulación del ovario con fármacos.
- Extracción de los óvulos mediante una punción que se realiza a través de la vagina y bajo sedación superficial.
- Fecundación de los óvulos en el laboratorio.
- Desarrollo de los embriones en incubadoras.
- Transferencia del embrión dentro del útero.
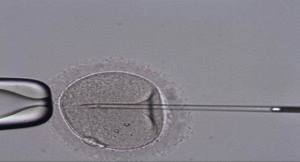
Existe una variante de la FIV convencional conocida como Inyección Intracitoplasmática de Espermatozoides (ICSI) que consiste en inyectar un espermatozoide directamente dentro del óvulo.
En función del lugar en el que se transfieren los gametos, se distinguen una gran variedad de técnicas: IVC (Intravaginal Culture), DIFI (Direct Intrafollicular Insemination), GIFT (Gametes Intrafallopian Transfer), GIPT (Gametes Intraperitoneal Transfer), GIUT or DIRGAT (Intrauterine Transfer of Ovum and Sperm), ICI (IntraCervical Insemination), IPI (IntraPeritoneal Insemination), ITI (IntraTubal Insemination), IUI (IntraUterine Insemination), LTOT (Low Tube Ovum Transfer) …entre otros
Técnicas de selección de esperma en ART
Dentro de estas técnicas, hay varios procesos comunes, así como otras variables que dependen de la modalidad elegida.
- Al principio, la muestra de semen se deposita en un tubo y se diluye en un medio de cultivo específico. El tubo se coloca en una pendiente en una incubadora durante un tiempo determinado. La incubadora tiene condiciones específicas de temperatura y composición del aire que determinan el medio tampón particular en el que se diluirá el semen para controlar el pH de la muestra. Después de la incubación, el sobrenadante se aspira, se introduce en un tubo vacío y luego está listo para la inseminación.
Las tres técnicas de preparación de esperma más frecuentemente utilizadas incluyen:
- Técnica de natación (SU), con sus variantes:
- Natación Directa (DSU),
- Natación Convencional (CSU).
- Técnicas de Centrifugación en Gradiente de Densidad (DGC)
- Técnicas de Migración-Sedimentación (MS)
Técnica de Natación
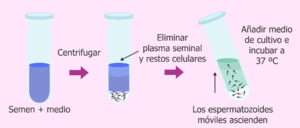
Se basa principalmente en la capacidad de movimiento de los espermatozoides, más concretamente, en la migración de los espermatozoides de acuerdo con su motilidad.
Esta estrategia consiste en concentrar la muestra de esperma para forzar a los espermatozoides con la mejor movilidad a migrar luego de la concentración celular a un medio de cultivo específico, que intenta emular al moco cervical.
Más tarde, los espermatozoides son rescatados e inseminados en el tracto reproductivo femenino (ya sea en el útero o directamente en las trompas).
- Al principio, la muestra de semen se deposita en un tubo y se diluye en un medio de cultivo específico.
- El tubo se coloca en una pendiente, se lleva a una incubadora durante un tiempo determinado.
- La incubadora tiene condiciones específicas de temperatura y composición del aire que determinan el medio tampón particular en el que se diluirá el semen para controlar el pH de la muestra.
- Después de la incubación, el sobrenadante se aspira.
- Se introduce en un tubo vacío.
- Por último, está listo para la inseminación.
Esta es la versión más simple de las Técnicas de Natación y generalmente se llama Natación Directa (Direct swim up) (DSU).
Se llama técnica convencional de natación Conventional swim‐up (CSU). A los protocolos que llevan a cabo una segunda centrifugación después del proceso de incubación, es decir, centrifugación-incubación-centrifugación, con las preparaciones de muestra correspondientes.
Técnica de Centrifugación en Gradiente de Densidad
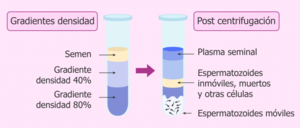
La idea consiste en preparar un tubo con dos capas bien diferenciadas:
- Una capa en la parte inferior con concentración de alta densidad.
- Otra capa con menor densidad.
Algunos protocolos incuban este tubo con capas separadas, simulando la temperatura del cuerpo humano.
Esta técnica DGC consiste en preparar gradientes de densidad que separarán los espermatozoides en función de un equilibrio, por lo que la densidad de los espermatozoides es igual a la de un gradiente.
- Después de la centrifugación de una muestra de semen, el plasma seminal flota en el gradiente de baja densidad y los espermatozoides inmaduros o muertos flotan entre los dos gradientes.
- Los espermatozoides maduros, que son de interés, son las células compactadas que alcanzan la capa de gradiente de mayor densidad, es decir, la parte inferior del tubo.
- Estos espermatozoides maduros se recuperan y luego se diluyen en un medio de preparación de espermatozoides.
- Se centrifugan una vez más.
- El resultante se resuspende en otro medio y se transfiere a un tubo o catéter, listo para la inseminación.
Técnica de Migración – Sedimentación
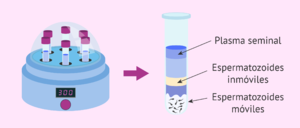
Este método se basa en la movilidad del esperma acompañado de la gravedad[1].
- Consiste en depositar semen en un tubo específico.
- Una vez depositado, el tubo está cubierto por un medio de lavado que supera la cámara de recarga.
- Luego se incuba.
- Los espermatozoides móviles migran, con la ayuda de la gravedad, desde la cámara hasta el fondo del tubo.
- Luego se extraen y están listos para ser inseminados.
También debe tenerse en cuenta que los métodos conjuntos a menudo se utilizan para la preparación del semen. Una de las combinaciones más populares corresponde a la Centrifugación en Gradiente de Densidad seguida de Técnica de Natación (DGC + SU)[2].
Efectos de la manipulación del semen
Por un lado, algunos estudios científicos intentan aclarar los mejores procedimientos para la Inseminación Artificial con respecto a sus tasas de éxito. La conclusión cada vez es definitiva: no hay evidencia científica disponible[4].
Un estudio realizado por Volpes[5] muestra, por ejemplo, que DSU y DGC + SU ofrecen poblaciones de esperma con ADN más intacto en comparación con PSU y DGC.
Recientemente, otro estudio también ha demostrado que la EM ofrece poblaciones de esperma con mejor movilidad y concentración en comparación con DGC-SU, según Kiratli[6].
Estos artículos no abordan el problema planteado por dos razones:
- La recolección de poblaciones de esperma más o menos dañadas no revela si las técnicas mismas dañan el esperma. Las diferencias encontradas pueden deberse exclusivamente a la capacidad de distinguir entre ellas.
- Dichos estudios tienden a usar semen espeso como un grupo de "control", lo cual es problemático, ya que el semen crudo se ve afectado por condiciones adversas fuera del tracto femenino.
Varios estudiosos del tema aseguran que el daño oxidativo que resulta de la generación de leucocitos de ROS y los espermatozoides inmaduros adyacentes a los espermatozoides maduros, explica no solo el problema de la disfunción iatrogénica de los espermatozoides, sino también el daño real que los espermatozoides pueden sufrir durante el manejo y manipulación del semen[7].
En conclusión, la manipulación de los gametos los afecta a todos ellos cuando se emplean técnicas para separar las poblaciones de esperma de baja calidad de las de mayor calidad.
De hecho, estas técnicas se han refinado para afectar al esperma lo menos posible, pero este menor impacto no equivale a cero impacto negativo.
Otras voces
Referencias
- ↑ 1,0 1,1 Mortimer, David (2000). «Sperm Preparation Methods». Journal andrology. doi:10.1002/j.1939-4640.2000.tb03390.x.
- ↑ 2,0 2,1 2,2 2,3 Rodrigo, Andrea; Ortega López, Leonor; Gijón Tévar, Luis; Trolice, Mark P. (3 de diciembre de 2019). «¿En qué consiste la capacitación de los espermatozoides?». Reproducción Asistida ORG. Consultado el 23 de junio de 2020.
- ↑ Agarwal, Virk, Ong y du Plessis, 2014
- ↑ Lemmens, L. (2017). «Predictive value of sperm morphology and progressively motile sperm count for pregnancy outcomes in intrauterine insemination». Semen section of the dutch foundation for quality assessment in medical laboratories 105: 1462 - 1468.
- ↑ Volpes et al., 2016
- ↑ Kiratli et al., 2018
- ↑ Balasuriya et al.2014; Kim et al. al.2015; Lopes, Sun, Jurisicova, Meriano y Casper, 1998; Mortimer, 1991