Genética clínica
Introducción[editar | editar código]
La genética es una rama de la biología que se ocupa del estudio de la herencia y la variación en los seres vivos.
Se ocupa del estudio de los factores genéticos implicados en las enfermedades humanas, bien sean hereditarias (que afectan al genoma en la línea germinal) o somáticas (que afectan al genoma individual en células, tejidos u órganos somáticos).
Dentro de la genética clínica existen diversos campos de interés, entre ellos se incluyen fundamentalmente
- El análisis de la estructura y función de los genes individuales (enfermedades debidas a genes alterados),
- El de los cromosomas implicados en una enfermedad (enfermedades con base cromosómica), el relativo a enfermedades complejas (genética del cáncer) y
- El diagnóstico.
Enfermedades debidas a sistemas genéticos alterados[editar | editar código]
Alrededor de un 5% de los niños recién nacidos presentan trastornos o algún tipo de enfermedad que puede poner en riesgo su vida, o requerir atención hospitalaria.
El hallazgo de la implicación de genes en enfermedades humanas se debió al médico inglés Sir Archivald Garrod en 1909, al descubrir la base hereditaria de una rara enfermedad llamada alcaptonuria, relacionada con el metabolismo de algunos aminoácidos, acuñando la denominación de “errores congénitos del metabolismo”[1]. Dadas las especiales limitaciones morales y éticas de la experimentación genética en el hombre, para el estudio de la base genética de un carácter (basada en otras especies en la realización de cruzamientos y estudio de las descendencias) se recurre al análisis de genealogías, consistente en el estudio de los antecedentes familiares de la enfermedad detectada en un paciente (denominado propositus) en todos los miembros de la familia (abuelos, padres, hermanos, tíos, primos y demás parientes). Este tipo de análisis se suele representar en unas cartas genealógicas, muy útiles cuando se trata de caracteres debidos a un solo gen, o monogénicos.

Sí esta situación se presenta en el nacimiento se dice que el tipo de problema es congénito y se podría tener una base genética.
En efecto, una alteración que aparece en el nacimiento no tiene porqué ser siempre debida a la alteración directa de un gen, puede haberse producido:
- Durante la vida intrauterina.
- Como resultado de un factor genético.
- Un factor físico (radiación).
- Un factor químico (fármacos, tóxicos).
- Un factor infeccioso.
También puede suceder que una patología o una enfermedad con base genética se manifieste después del nacimiento, a una edad más o menos avanzada.
- Un trastorno genético hereditario consiste en un error, una mutación génica o cromosómica, que se transmite desde los padres en el momento de la fecundación, siendo canalizado a través de uno de los dos gametos. La base molecular de la alteración consiste en algún tipo de mutación en la información de un gen por adición, pérdida o sustitución de bases nucleotídicas, en la región codificante o en las zonas reguladoras de su expresión, o puede afectar a una región cromosómica o incluso de uno o más cromosomas completos.
- La mutación en el ADN de un gen, o la variación del nivel de su expresión, puede acarrear la producción de una proteína alterada, defectuosa o incompleta, o la deficiencia total de ella, o su síntesis por debajo o por encima del umbral necesario para el normal funcionamiento de un sistema metabólico. Como consecuencia de ello se puede producir un fenotipo alterado que puede manifestarse en forma de una enfermedad.
- También pueden surgir alteraciones genéticas somáticas, a lo largo del desarrollo o de la vida de un individuo. Este sería el caso de las mutaciones espontáneas en alguna célula perteneciente a un tejido somático. La mutación se transmitirá a todas las células descendientes, que heredarán las posibles variaciones en la manifestación del gen o genes alterados. En este caso se hablaría de alteraciones somático-genéticas y se diría que no son transmisibles de padres a hijos, aunque sí tienen una causa genética. Este es el caso de la mayoría de los tipos de cáncer y también de la aparición de fenómenos de mosaicismo por la diferente manifestación de caracteres fenotíficos en distintas zonas del cuerpo.
- En el contexto de las enfermedades se ha de dejar aparte las adquiridas, entendiendo por tal las que supongan una alteración del desarrollo normal o del funcionamiento del metabolismo, defensas, etc., de un organismo por causas ambientales, externas al genoma o al genotipo del individuo. Aquí se situarían las enfermedades infecciosas, o las debidas a influencias ambientales, defectos en la alimentación, etc. En este caso, no se puede hablar de causas genéticas directas, aunque sí pueden suponerse razones de predisposición por constitución genética y podrían habilitarse terapias que modifiquen la respuesta del organismo ante determinadas contingencias.
En principio se asume que una enfermedad es hereditaria cuando se dan las siguientes circunstancias:
- Cuando aparece con más frecuencia entre parientes relacionados genéticamente que con otros individuos de la población.
- Cuando es poco frecuente en personas no relacionadas genéticamente, aun cuando vivan en el mismo ambiente.
- Cuando aparecen a una edad determinada sin ninguna causa ambiental aparente que lo produzca.
- Cuando presenta diferentes frecuencias en diferentes poblaciones.
- Cuando los gemelos monocigóticos (idénticos genéticamente) comparten más a menudo el carácter que los gemelos dicigóticos (fraternos).
Tras el desarrollo del Proyecto Genoma Humano se ha facilitado el análisis de las secuencias de los genes involucrados en enfermedades, mediante un estudio comparado entre individuos sanos y afectados y también mediante análisis de secuencias homólogas en animales de experimentación, ensayos clínicos en animales transgénicos, etc. De este modo se han llegado a conocer las funciones de más de la mitad de los genes humanos.
Existe un gran Banco mundial de datos llamado OMIM[3] en el que se relacionan todos los genes conocidos en el hombre y las enfermedades debidas a sus alteraciones.
Respecto al patrón hereditario de las enfermedades hay que distinguir entre:
- Las monogénicas, debidas a un solo gen.
- Las poligénicas, que constan de un gran número de genes repartidos por el genoma que interaccionan entre sí (genes menores, factores múltiples, o políméricos).
En las monogénicas: hay que distinguir entre las determinadas por alelos dominantes (que enmascaran a cualquier otro alelo cuando se encuentran en heterocigosis; por ej.: si A domina sobre a, el genotipo AA es igual al Aa y ambos diferentes al aa), o por alelos recesivos (que son los que quedan enmascarados por otro u otros alelos del mismo gen en el caso de encontrarse en heterocigosis; en el ej. anterior, el genotipo Aa muestra el fenotipo de A y a queda enmascarado). También puede haber enfermedades mitocondriales, debidas a la alteración en el ADN de las mitocondrias, con sede en el citoplasma de las células y cromosómicas, debidas a alteraciones en la estructura o en el número de cromosomas.
De acuerdo con la posición de los genes en los cromosomas del cariotipo humano y dada la especial dotación cromosómica en el hombre (46,XX en la mujer, 46,XY en el varón) a los efectos de transmisión se distingue entre las enfermedades autosómicas (genes en alguno de los 22 autosomas) y ligadas al sexo (genes en X o Y). De los más de 19.000 genes incluidos en el Banco de datos OMIM, cerca de 18.000 tienen su locus en autosomas, cerca de 1.000 en el cromosoma X, unos 50 en el cromosoma Y y unos 60 en las mitocondrias.
Dado que los genes tienen su sede en los cromosoma, se utiliza una simbología para referirse al cromosoma, brazo cromosómico y región en que se localizan. De este modo, se indica:
- En primer lugar un número, correspondiente al cromosoma en el que tiene su locus el gen.
- En segundo lugar se añade la letra p ó q para referirse al brazo del cromosoma en que se encuentra, corto o largo, respectivamente.
- Finalmente se añade dos cifras correspondientes a la región del brazo (banda o interbanda en que se localiza, de acuerdo con el mapa de regiones teñidas y no teñidas reveladas mediante las técnicas citogenéticas de bandeo para la visualización microscópica de los cromosomas).
- Una segunda cifra separada por un punto precisa aún más esta localización. Así, por ejemplo, al señalar que el gen de la huntingtina tiene su sede en 4p16.3 estamos indicando que su locus está en el brazo corto del cromosoma 4, región 16 y subregión 3.
| Los criterios por los que se rige la herencia autosómica dominante son los siguientes: |
|---|
| El carácter aparece en cada generación; tiene un 50% de probabilidad de herencia en hijos de afectados. |
| Hay un 50% de riesgo de recurrencia en hermanos de afectados; si ningún miembro de la pareja está afectada, no existe riesgo de transmisión a los hijos |
| Hay igual riesgo de transmisión a hijos varones y mujeres. |
| Entre los ejemplos de enfermedades autosómicas dominantes se encuentra: la Enfermedad de Huntington (HD), una enfermedad mental que se manifiesta hacia la cuarta década de la vida. Su base molecular consiste en un incremento de longitud del gen de la huntingtina, localizado en 4p16.3. La mutación consiste en una inserción de múltiples tripletes CAG en el ámbito del gen. |
| Otro ejemplo es la Neurofibromatosis de Von Recklinghausen (NF1), que se manifiesta por unos tumores fibromatosos en la piel debidos a mutaciones en el gen NF1, que se localiza en 17q11.2. También tiene herencia autosómica dominante un tipo de hipercolesterolemia familiar, cuyo gen se localiza en 19p13 y que se identifica por unos depósitos de colesterol en tendones, piel, arterias y va acompañada de enfermedad cardiaca coronaria. |
| Los criterios por los que se rige la herencia autosómica recesiva son los siguientes: |
|---|
| Si un fenotipo autosómico recesivo aparece en más de un miembro de un grupo familiar, generalmente se observa solo entre los hermanos del propósitus, no en los padres ni en los descendientes, ni en otros familiares. |
| Existe un 25% de probabilidad de recurrencia para cada hermano del propósitus; los padres suelen ser consanguíneos, sobre todo cuando el carácter es raro en la población. |
| Existe igual riesgo en varones y mujeres. |
| Un ejemplo de una enfermedad autosómica recesiva es la Fibrosis Quística (CF), que causa una alteración pulmonar y pancreática crónica asociada a defectos en la canalización de iones hacia el interior de las células. Se debe a una mutación del gen CFTR con sede en 7q31.2, que sintetiza una proteína de la membrana celular. |
| Otro ejemplo lo constituye la enfermedad de Tay-Sachs (TSD), un clásico defecto genético neurodegenerativo determinado por la mutación en el gen HEXA, con sede en 15q23-q24, que determina la deficiencia en la síntesis de la enzima Hexosaminidasa A, lo que se traduce en gangliosidosis, parálisis, demencia y ceguera.
El mismo tipo de herencia la manifiesta un tipo de albinismo oculocutáneo, que se debe a un defecto en el gen que codifica la enzima tirosinasa, localizado en el cromosoma 11 (11q14-q21) e implicado en el metabolismo de la tirosina, lo que determina la falta de melanina, pigmentos de la piel y del pelo. Se podrían citar muchas otras enfermedades debidas a mutaciones recesivas que conducen a deficiencias en enzimas u otros tipos de proteínas. |
La herencia mitocondrial se refiere a la transmisión de desórdenes debidos a defectos en el ADN mitocondrial. La transmisión tiene lugar exclusivamente de madres a hijos, dado que en la fecundación el ovocito aporta el citoplasma además del núcleo, mientras que el espermatozoide solo aporta núcleo. Para este tipo de herencia existe igual riesgo de transmisión a hijos varones y mujeres. Como ejemplo de enfermedad mitocondrial, se puede señalar la Atrofia Óptica Hereditaria de Leber (LHON) que se manifiesta en la edad madura con una pérdida de agudeza en la visión que puede conducir a la ceguera. Se han descrito hasta 18 alelos diferentes debidos a distintas mutaciones de cambio de bases en el ADN mitocondrial.
Enfermedades con base cromosómica[editar | editar código]
Un capítulo importante de la Genética Clínica lo constituyen las enfermedades cromosómicas, debidas a la aparición de cariotipos alterados respecto a la constitución cromosómica normal. Se estima que un 15% de los embriones humanos no llegan a término por aborto espontáneo y que de ellos la mitad se deben a aberraciones cromosómicas. Las variaciones cromosómicas pueden afectar a la dotación cromosómica autosómica, a los cromosomas sexuales, o al conjunto del cariotipo. Inicialmente suelen clasificarse en variaciones numéricas (poliploidía y aneuploidía) y variaciones estructurales (deleciones, duplicaciones, inversiones y translocaciones).
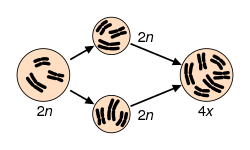
Se denominan poliploides a las dotaciones de más de dos juegos cromosómicos completos. Se trata de un tipo de variación equilibrada (euploide), porque los cromosomas guardan las mismas proporciones relativas que en un organismo diploide normal. Sin embargo, la poliploidía tiene consecuencias muy graves en el hombre. Se estima que aproximadamente el 1,3 % del total de los abortos espontáneos se deben a casos de triploidía (69,XXX; 69,XXY; 69,XYY) y el 0,45 % a tetraploidía (92,XXXX; 92,XXXY; 92, XXYY). Los poliploides normalmente se producen por fertilización de un óvulo por más de un espermatozoide, o por fallo de una de las divisiones de maduración en el óvulo o en el esperma, lo que da lugar a la formación de gametos diploides.
Se llaman variaciones numéricas aneuploides o desequilibradas aquellas en las que el número cromosómico resultante no es múltiplo del complemento cromosómico básico de la especie. Los aneuploides suelen originarse por causa de una meiosis anormal en la que como consecuencia de asinapsis, desinapsis o no-disyunción se forman gametos con cromosomas de más o de menos (la asinapsis, desinapsis y no disyunción, se refieren a fallos en la primera división meiótica, consistentes respectivamente en la falta de apareamiento de cromosomas homólogos, la separación precoz una vez formado el bivalente o la no separación de los cromosomas apareados y su inserción errónea en una de las dos células hijas de la primera división meiótica).
Las aneuploidías de autosomas en la especie humana van asociadas a graves alteraciones fenotipicas que determinan abortos espontáneos (aproximadamente el 4%), o determinan una supervivencia postnatal corta o muy corta. La mayor excepción es la trisomía 21 (tres cromosomas 21 en lugar de dos) causante del síndrome de Down, que afecta al 0,12% de los recién nacidos, aunque aproximadamente 3 de cada cuatro embriones con trisomía 21 no llegan a nacer.
Dicha trisomía está asociada a unas alteraciones fenotipicas características:
- Hipotonía muscular.
- Fácies mongoloide.
- Dedos cortos con dermatoglifos palmares característicos.
- Retraso mental.
Los cambios sociales, que han representado la mejora en las técnicas educativas y de la medicina preventiva, han aumentado la capacidad de supervivencia y la calidad de vida de las personas afectadas por este síndrome en los países desarrollados. Las mujeres con síndrome de Down pueden ser fértiles y pueden tener descendencia normal o trisómica, pero los varones son estériles.
El riesgo de tener hijos con síndrome de Down aumenta con la edad materna. Por esta razón es aconsejable con carácter preventivo realizar un análisis cromosómico fetal en casos de madres con edades próximas o superiores a los 40 años. Solo hay otros dos tipos de aneuploidías autosómicas viables, la trisomia del cromosoma 13, responsable del síndrome de Patau y la del 18, que determina el síndrome de Edwards. En ambos casos los recién nacidos sufren alteraciones físicas y mentales muy graves siendo la esperanza de vida muy corta, con una mortalidad superior al 90% en unas pocas semanas. Todas las demás trisomías terminan en aborto espontáneo.
Las aneuploidías que afectan a los cromosomas sexuales tienen en general un efecto fenotípico menos acusado. Aproximadamente el 0,22 % de los nacidos vivos presentan una aneuploidía que afecta a los cromosomas sexuales. Cada uno de los tipos que se describen a continuación afecta aproximadamente a 1 de cada 1.000 nacidos vivos.
Las mujeres 45,X presentan el síndrome de Turner y suponen el único caso de seres humanos viables con un cromosoma de menos (monosómicos), aunque aproximadamente el 18% de todos los abortos causados por anormalidades cromosómicas tienen esta constitución cromosómica. Presentan:
- Baja estatura.
- Inteligencia normal.
- Esterilidad.
Los varones de constitución 47,XXY poseen el síndrome de Klinefelter. Presentan:
- Un fenotipo caracterizado por una estatura alta.
- Esterilidad asociada a atrofia testicular.
- Pueden mostrar problemas de integración psicosocial.
Los varones 47,XYY son:
- Altos de estatura.
- Desarrollo sexual normal.
- Inteligencia normal.
- De forma controvertida se les asocian comportamientos violentos.
Las mujeres 47,XXX son generalmente:
- Altas.
- Fértiles.
- Fenotípicamente normales.
- Aunque con reducción del coeficiente intelectual.
Finalmente existen constituciones de tipo mosaico, caracterizadas por la existencia de dos o más tipos de dotaciones cromosómicas en diferentes células: 46,XX/45,X, 47,XXX/45,X, 47,XXY/46,XY, 47,XXX/46,XX/45,X. Todos estos errores tienen por causa fallos en el reparto de los cromosomas implicados durante la meiosis para la formación de los gametos, femeninos o masculinos.
Las variaciones cromosómicas estucturales, son responsables de muchos casos de inviabilidad en el desarrollo y numerosos síndromes en nacidos vivos. Estas variaciones pueden ser de nivel molecular, y por lo tanto no observables al microscopio, o lo suficientemente grandes como para observarse la alteración en el nivel cromosómico.
Respecto a las alteraciones cromosómicas, existen métodos citogenéticos de detección en el cariotipo. Principalmente se estudian las bandas-G y -R, que permiten la identificación de regiones en los cromosomas al ser sometidos a una tinción especial. También se recurre al pintado cromosómico, basado en el reconocimiento específico de cada cromosoma mediante unas sondas de ADN marcadas con fluorocromos.
Genética del cáncer[editar | editar código]
Un capítulo importante de la genética clínica lo constituye el cáncer, aunque no se trata de una enfermedad hereditaria sino de origen somático. Solo el 5% de los cánceres parecen seguir un patrón familiar. Afecta a la normal proliferación de las células somáticas y puede sobrevenir en muy diferentes momentos a lo largo de la vida y en diversidad de tejidos. Afecta a más de la tercera parte de la población humana y provoca más del 20% de las muertes. En países desarrollados genera más del 10% del coste de la atención médica. La progresión del cáncer implica la expresión de ciertos genes. Se conocen dos tipos de genes de actividad antagónica:
- Los protooncogenes que cuando mutan a oncogenes generan la formación de tumores por estimulación del ciclo celular, y los genes supresores, cuya función normal es impedir el desarrollo del tumor. El cáncer puede deberse a mutaciones espontáneas en uno de estos tipos de genes o ser inducido por la acción de carcinógenos químicos, físicos o biológicos (virus tumorales y retrovirus) que ejercen su acción sobre estos mismos tipos de genes.
El diagnóstico Genético[editar | editar código]
Para un número importante de enfermedades cuya causa genética es conocida se han desarrollado terapias bioquímicas o farmacológicas adecuadas, que tratan de mitigar o contrarrestar la deficiencia o la alteración bioquímica que la determina. Muchas de las enfermedades anteriormente indicadas pueden ser diagnosticadas e incluso pronosticadas desde antes de su manifestación, en los embriones mediante el diagnóstico genético preimplantatorio (PGD), en el feto en formación, mediante un diagnóstico prenatal a partir de una muestra de líquido amniótico o vellosidades coriónicas, o en cualquier momento después del nacimiento a partir de muestras de ADN de células adultas.
Para ello se aplican una serie de técnicas de análisis cromosómico, o de las secuencias de ADN correspondientes a los genes implicados, o de expresión de proteínas, etc. El diagnóstico genético preimplantatorio se lleva a cabo como una alternativa al diagnóstico prenatal, con el fin de seleccionar embriones en conexión con las técnicas de reproducción asistida para parejas que tienen un riesgo demostrado de transmitir un desorden genético a su descendencia.

En la Ley de Reproducción Asistida[6] (Ley 14/2006) reguló y autorizó el diagnóstico genético preimplantatorio, mediante análisis del ADN tomado de una o dos células de los embriones producidos in vitro. Esta tecnología se utiliza para eludir descendientes con determinadas enfermedades genéticas o para la creación de los llamados “bebés medicamento”. Sin embargo, se suele ocultar que esta tecnología tiene sus riesgos e incertidumbres. Así se pronunció la Sociedad Americana de Medicina Reproductiva[7] en un informe emitido en 2001:
"La práctica del diagnóstico genético preimplantatorio supone una alternativa viable respecto a la interrupción del embarazo. El procedimiento actualmente se limita a ciertas enfermedades genéticas y se realiza en centros especializados en donde coexiste el asesoramiento genético y la experiencia en técnicas de genética molecular y desarrollo embrionario. Es necesario indicar a los pacientes que sean conscientes de los posibles errores potenciales en el diagnóstico y la posibilidad de efectos negativos a largo plazo, actualmente desconocidos, sobre el feto como consecuencia del procedimiento de la biopsia practicada en el embrión"
Naturalmente el PGD, se practica con un fin preconcebido de seleccionar embriones, lo que supone el sacrificio o la eliminación de los no seleccionados, ya que la congelación de los embriones manipulados tras la extracción de una o dos células no es recomendada. Tanto el PGD como el diagnóstico prenatal deberían tender a beneficiar al propio ser humano que está en el embrión o en el feto, y no a su destrucción o selección con fines distintos a los de su propio beneficio.
Se podría decir que al igual que en otros desarrollos experimentales de las ciencias biomédicas modernas, se prevé un futuro esperanzador de la mano de dos áreas de la biología en continua evolución, la genética y la biología celular. La terapia génica derivada del Proyecto Genoma Humano, consistente en una modificación genética en las células, alumbrará previsiblemente nuevas formas de atacar numerosas enfermedades, incluso desde las primeras etapas del desarrollo. Sin duda hay mucho camino por recorrer, pero hace falta un ordenamiento jurídico que respete la vida humana y establezca los límites de las aplicaciones biomédicas.
Otras voces[editar | editar código]
Texto de referencia[editar | editar código]
- Jouve de la Barreda, Nicolás (Mayo 2012). «Voz:Genética clínica». Simón Vázquez, Carlos, ed. Nuevo Diccionario de Bióetica (2 edición) (Monte Carmelo). ISBN 978-84-8353-475-5.
Bibliografía[editar | editar código]
- American Society for Reproductive Medicine (2001). A Practice Committee Report. Preimplantation Genetic Diagnosis.
- Jorde, L.B; Carey, J.C; Bamshad, M.J; White, R.L. Genética Médica (3ª Edición edición). Madrid: Mosby. p. 368. ISBN 9788491130598.
- Jouve, N. (2004). Biología, vida y sociedad. UNESCO. Madrid: Editorial Antonio Machado. p. 187. ISBN 8477741441.
- Jouve, N. (2008). Explorando los genes. Del bigbang a la nueva biología (en inglés). Ediciones Encuentro Madrid. p. 520. ISBN 8474909015.
- Novo Villaverde, F.J (2007). Genética Humana. Conceptos, mecanismos y aplicaciones de La Genética en el campo de la Biomedicina. Madrid: Person, Prentice Hall. p. 304. ISBN 8483223597.
- Nussbaun, R; McInnes, R.R; Williard, H.F (2005). Genética en Medicina (5ª Edición edición). Barcelona: Masson.
- Passarge, E. (2004). Genética. Texto y Atlas (2ª Edición edición). Buenos Aires: Ed. Panamericana. p. 486. ISBN 8498351928.
- Solari, A.J (2004). Genética Humana. Fundamentos y Aplicaciones en Medicina (3ª edición edición). Buenos Aires: Ed. Panamericana. p. 556. ISBN 9789500602693.
Referencias[editar | editar código]
- ↑ Lemes, Aída (2003). «Errores congénitos del metabolismo». Archivos de Pediatría del Uruguay 74 (1): 33 - 36. Consultado el 14 de junio de 2020.
- ↑ José L. Fresquet. «Archibal Edward Garrod (1857-1936)».
- ↑ NCBI. «OMIM». Consultado el 30 junio 2020.
- ↑ «Poliploidía». Wikipedia. 26 de mayo de 2020. Consultado el 14 de junio de 2020.
- ↑ American Society for Reproduction Medicine. «Pruebas genéticas previas a la implantación (incluido el diagnóstico genético previo a la implantación y la detección genética previa a la implantación)». Consultado el 30 junio 2020.
- ↑ «Ley 14/2006, de 26 de mayo, sobre técnicas de reproducción humana asistida.». Boletín Oficial del Estado. 28/05/2006. Consultado el 14 de junio de 2020.
- ↑ «Sociedad Americana de Medicina Reproductiva».