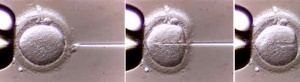
Inyección intracitoplasmática de espermatozoides
La inyección introcitoplasmática de especmatozoides (Intracytoplasm sperm injection - ICSI) es una técnica de reproducción asistida extracorpórea que consiste en la inyección de un solo espermatozoide en el citoplasma del óvulo.
Antes de que el espermatozoide de un hombre pueda fertilizar el óvulo de una mujer, la cabeza del espermatozoide tiene que fijarse en la superficie exterior del óvulo. Luego, debe empujar a través de la capa exterior del óvulo para llegar al interior (citoplasma). A veces, el espermatozoide no puede atravesar esa capa exterior. Un procedimiento conocido como inyección intracitoplasmática de espermatozoides (ICSI) nos permite fertilizar el óvulo mediante la inyección directa del espermatozoide en el óvulo [1]
¿Cómo funciona la ICSI?
En la fertilización in vitro (FIV) tradicional, los espermatozoides se mezclan con el óvulo de la mujer en el laboratorio. Si se requiere ICSI, se utiliza una pequeña aguja para inyectar un espermatozoide directamente en el citoplasma del óvulo. El óvulo fertilizado crece en un laboratorio entre uno y cinco días, luego se coloca en el útero de la mujer (matriz).
¿Por qué se necesitaría la ICSI?
La ICSI ayuda a superar los problemas de fertilidad de un hombre, por ejemplo si:
- Produce muy pocos espermatozoides
- Los espermatozoides no tienen la forma correcta o no se mueven de manera normal
- Los espermatozoides tienen dificultad para fijarse al óvulo
- Una obstrucción en el aparato reproductor masculino impide la salida de los espermatozoides
- La ICSI también puede utilizarse cuando no se ha logrado la fecundación con la FIV tradicional, independientemente de la condición de los espermatozoides. [1]
Por tanto la indicación de uso de la ICSI es la esterilidad masculina . Basta que haya algún espermatozoide en el semen, el epidídimo o el testículo.
El primer éxito de ICSI se produce en 1992 en Bélgica[2]. Tras inyectar un espermatozoide en 47 ovocitos, 38 permanecieron intactos después de la inyección, 31 resultaron fecundados, y 15 embriones fueron puestos en útero. Tras 8 ciclos de tratamiento resultaron 4 embarazos: 2 de 1 feto, 1 de gemelos, y 1 aborto preclínico. Han nacido 2 niños de los embarazos individuales y 1 de la gestación gemelar.
Aunque es una técnica muy difundida por su efectividad, se ha observado que esta facilidad para conseguir la fecundación lleva aparejado el aumento de riesgo de enfermedades genéticas en el embrión.
Riesgos de alteraciones genéticas
Además de los efectos que pueda producir el hecho de tratarse de una fecundación in vitro hay que tener en cuenta las especificidades del método ICSI.
Un informe exhaustivo de febrero de 2005 [3] del Ministerio de salud de Nueva Zelanda recoge los datos publicados en todos los países sobre la salud de los niños generados por FIV e ICSI, y pone de manifiesto que estos últimos tienen más riesgo de tres a cuatro veces mayor que los concebidos naturalmente de anormalidades crosomómicas. En buena medida las alteraciones son heredadas de los gametos paternos.
Los trabajos del equipo de Bonduelle [4] analizan el riesgo de una anormalidad cromosómica nueva, no presente en los gametos; encuentran que es de 1.6% para los generados por ICSI frente a un 0.5% de los concebidos. Estas alteraciones fetales nuevas consisten fundamentalmente en un incremento del número de cromosomas sexuales, que cursan con esterilidad, y sus manifestaciones fenotípicas son indetectables al nacer y en los primeros años de vida. Se ha relacionado la incidencia de alteraciones en los niños de ICSI con alteraciones del cromosoma Y paterno [5] Actualmente, las técnicas de biomedicina están permitiendo la disección de los genes del cromosoma Y que se requieren para la fertilidad masculina; este análisis permitirá un mejor diagnostico de la causa de infertilidad y permitiría la posibilidad de una información rigurosa a quienes acuden a la ICSI y valorar con ello las malformaciones esperables en los hijos.
Una amplia revisión [6] de los riesgos de transmisión de enfermedades genéticas pone de manifiesto que un 6% de los varones estériles tienen un cariotipo con anomalías del tipo de trisomías de los cromosomas sexuales. Por ejemplo el Síndrome de Klinefelter, que ocurre en 1 por 500 varones vivos, afecta al 14% de los hombres con azoospermia no obstrutiva. En otros casos son reordenaciones cromosómicas debidas a traslocaciones, inversiones y deleciones. También se ha descrito [7] que el 6.1% (134 de 2.190 varones) de los que necesitaron ICSI para concebir tenían una reordenación cromosómica. La frecuencia es más alta (18.71%) en varones con azoospermia que en los que tienen severa (14.55%) o moderada (2.37%) oligozoospermia. Otro defecto en los que padecen azoospermia no obstructiva, o oligospermia severa, es una deleción en el cromosoma Y en una región Yq11(AZF) que contiene genes implicados en la espermatogénesis [8] [9]. En el 1–2% de varones estériles hay una mutación en el gen regulador de la conductancia de la membrana (CFTC) que origina una forma genital de la fibrosis quística.
La edad de las mujeres que acuden a las ART es generalmente mayor que las que conciben espontáneamente, por lo que los hijos tienen alteraciones cromosómicas en mayor proporción. Sin embargo, se ha encontrado un aumento significativo de aberraciones cromosomicas tras ICSI respecto a FIV en un estudio que abarca el registro de 1995–2000 en Dinamarca [10] , incluso si la madre era más joven. En los últimos años, la maduración in vitro de los oocitos obtenidos por estimulación ovárica ha comenzado a ser un paso de rutina en las técnicas de reproducción asistida. Se ha observado que este proceso no incrementa el riesgo de alteraciones congénitas, embarazos múltiples, partos por cesárea, mayor siempre respecto a los nacidos concebidos naturalmente [11]. No obstante, cuando la esterilidad femenina se debe a ovario poliquistico, la maduración de los óvulos in vitro lleva consigo pérdidas del embrión muy altas, tanto si se generan por FIV como por ICSI [12].
El hecho de introducir directamente el espermatozoide en el óvulo ocasiona que también se introduzcan estructuras espermáticas que pueden transmitir al ovocito defectos cromosómicos presentes en el espermatozoide. El espermatozoide que penetra no es el mejor –como ocurre en el proceso natural–, lo que conlleva un aumento de riesgos para el nuevo individuo.
También se ha constatado un aumento de la incidencia de gemelación del cigoto, y consecuentemente del número de gemelos en los nacimientos.
Valoración ética
En el caso de plantearse acudir a la ICSI, además de las consideraciones éticas que deben tenerse en cuenta en la utilización general de las técnicas de reproducción asistida, deberá contarse con este aumento de los riesgos para el embrión y para la madre.
Referencias
- ↑ 1,0 1,1 AMERICAN SOCIETY FOR REPRODUCTIVE MEDICINE (2011). «Inyección intracitoplasmática de espermatozoides (ICSI)». Sitio Web de Educación del Paciente de la American Society for Reproductive Medicine. Consultado el 1 de noviembre de 2012.
- ↑ Palermo, G.; Joris, H.; Devroey, P.; Van Steirteghem, A.C. (4 de julio 1992). «Pregnancies after intracytoplasmic injection of single spermatozoon into an oocyte». The Lancet 340 (8810): 17-18. doi:10.1016/0140-6736(92)92425-F.
- ↑ Marjoribanks, J.; Farquhar, C.; Marshall, C. (2005). Systematic review of the health risks to the mother, child and family associated with the use of intracytoplasmic sperm injection (ICSI). Report to the Ministry of Health from the New Zealand Guidelines Group undertaken by the Cochrane Menstrual Disorders and Subfertility.
- ↑ Bonduelle, M.; Van Assche, E.; Joris, H.; Keymolen, K.; Devroey, P.; Van Steirteghem, A.; Liebaers, I. (2002). «Prenatal testing in ICSI pregnancies: incidence of chromosomal anomalies in 1586 karyotypes and relation to sperm parameters». Human Reproduction 17: 2600-2614.
- ↑ Katagiri, Yukiko; Neri, Queenie V.; Takeuchi, Takumi; Schlegel, Peter N.; Megid, Wael A.; Kent-First, Marijo; Rosenwaks, Zev; Palermo, Gianpiero D. (2004). «Y chromosome assessment and its implications for the development of ICSI children». Reproductive BioMedicine Online 8 (3): 307-318. doi:10.1016/S1472-6483(10)60911-X.
- ↑ Lipshultz, L.I.; Lamb, D. J. (2007). «Risk of transmission of genetic diseases by assisted reproduction». Nature Clinical Practice Urology (4): 460-461.
- ↑ Gekas, J.; et al. (2001). «Chromosomal factors of infertility in candidate couples for ICSI: an equal risk of constitutional aberrations in women and men». Human Reproduction (16).
- ↑ Tiepolo,, L.; Zuffardi, O. (1976). «Localization of factors controlling spermatogenesis in the nonfluorescent portion of the human Y chromosome long arm». Human Genet (34).
- ↑ Reijo, R.; et al. (1996). «―Severe oligozoospermia resulting from deletions of azoospermia factor gene on Y chromosome». Lancet: 1290-1293.
- ↑ Gjerris,, A.C.; Loft, A.; Pinborg, A.; Christiansen, M.; Tabor, A. (2008). «Prenatal testing among women pregnant after assisted reproductive techniques in Denmark 1995–2000: a national cohort study». Human Reproduction (23): 1545-1552.
- ↑ Buckett, W.M.; Chian, R.C.; Holzer, H.; Dean, N.; Usher, R.; Lin Tan, S. (2007). «Obstetric Outcomes and Congenital Abnormalities After In Vitro maturation, In Vitro Fertilization, and Intracytoplasmic Sperm Injection». Obstet Gynecol (110): 885-891.
- ↑ Buckett, W.M.; Chian, R.C.; Dean, N.L.; Sylvestre, C.; Holzer, H. E. G.; Lin Tan, S. (2008). «Pregnancy loss in pregnancies conceived after in vitro oocyte maturation, conventional in vitro fertilization, and intracytoplasmic sperm injection». Fertil Steril (90): 546-550.